Otto Heinrich Warburg nació el 8 de octubre de 1883 en Friburgo, Baden-Württemberg, Alemania. En ese momento, su padre (Emil Warburg) era un eminente profesor de física en la Universidad de Friburgo. La madre de Otto era Elizabeth Gaertner. Se habla de ella como una mujer de gran vitalidad e ingenio. Otto pensó que los rasgos esenciales de su personalidad provenían de su madre y su lado de la familia. Aunque Otto nació en una familia judía de renombre, su padre se había convertido al cristianismo antes de su nacimiento y su madre era protestante. El linaje familiar se originó en la hermosa y pequeña ciudad de Warburg, a unas treinta millas al oeste de Gotinga, a mediados del siglo XVI.
Otto, junto con sus tres hermanas, creció en un ambiente académico. Como era común entre las familias de los profesores, los Warburgs residían en el instituto de Emil (para permitirle concentrarse en la investigación). El padre de Otto trabajaba sin cesar.
En 1896 (cuando Otto tenía 12 años), la familia se mudó a Berlín, donde Emil se había convertido en Director del Instituto de Física de la Universidad de Berlín. A través de su membresía en la prestigiosa Academia de Ciencias de Prusia, Emil estuvo en estrecho contacto con colegas científicos como Albert Einstein y Max Planck. La casa de Warburg se convirtió en un estimulante centro cultural que puso al joven Otto en estrecho contacto con destacados académicos de Berlín, así como con artistas.
Es más probable que la verdad surja del error si es clara y definida, que por confusión, y mi experiencia me enseña que es mejor tener una opinión comprendida e inteligible, incluso si resulta ser incorrecta, que contentarse con una mezcla confusa de puntos de vista conflictivos, a veces llamada imparcialidad, y a menudo no es mejor que ninguna opinión.
-Otto Heinrich Warburg


El padre de Otto Warburg también fue un pianista consumado: durante las tardes sociales, no era raro ver a Einstein tocar el violín y Emile Warburg y Max Planck en el piano, junto con otros colegas como JH van't Hoff y Walter Nernst contribuyendo a El entretenimiento musical, literario y filosófico.
A los 18 años, Otto decidió estudiar química. Salió de Berlín en 1901 para matricularse en la Universidad de Friburgo, para poder estudiar con el reconocido Dr. Emil Fischer.
El Dr. Fischer recibió el Premio Nobel en 1902 por la síntesis de azúcares y purinas. Era un maestro exigente, que requería precisión en los experimentos y el pensamiento, y perseverancia en la ciencia. Las primeras investigaciones de Otto con el Dr. Fischer se centraron en los polipéptidos. En 1906, el Dr. Warburg completó su Ph.D. disertación química, titulada Über Derivative des Glycocolls, Alanins und Leucins. Über die 1-Brompropionsäure und das 1-Alanylglycin ( En derivados de glicina, alanina y leucina. En ácido 1-bromopropiónico y alanilglicina ).
En la Universidad de Freibur, el Dr. Warburg se familiarizó con Julian Huxley (biólogo evolutivo), Viktor von Weizsäcker (fundador de la medicina psicosomática), Archibald Vivian Hill (un fisiólogo inglés y luego ganador del Premio Nobel de fisiología), y Otto Meyerhof (bioquímico y ganador del Premio Nobel de fisiología). Estas grandes mentes tuvieron una influencia duradera y significativa en el joven Dr. Warburg.
El Dr. Warburg quería aplicar los conceptos y métodos que había adquirido en su estudio de química y física para comprender los procesos energéticos de la vida. Comenzó a experimentar con diferentes tipos de células: bacterias, levaduras y glóbulos rojos. Durante los veranos de 1908 a 1911, a menudo junto con Meyerhof, visitó la Estación Marina en Nápoles, Italia, donde realizó sus primeras observaciones astutas con huevos de erizo de mar. En estas investigaciones embriológicas de huevos de erizo de mar, había observado un rápido aumento en la absorción de O2 y la división celular rápida posterior a la fertilización. Postuló que los tejidos cancerosos de división celular rápida también podrían absorber más O2 que el tejido normal.
Este trabajo finalmente convergió en una segunda tesis doctoral en 1911 sobre la oxidación de células vivas realizadas con huevos de erizo de mar como sistema modelo, sentando las bases para sus investigaciones posteriores sobre el cáncer. En la década de 1920, el Dr. Warburg se propuso probar si las células cancerosas habían aumentado el consumo de oxígeno.
Con esta sólida base científica, Otto estaba en camino a una carrera prometedora. Era excepcionalmente ambicioso, y confesó que quería superar los logros de su padre. Tenga en cuenta: a la edad de 30 años, Emil Warburg había alcanzado una de las principales posiciones disponibles para los físicos en la Alemania imperial (cátedra de física en la Universidad de Friburgo).
Universidad de Friburgo

Friburgo ca. 1900
Otto todavía quería saber más sobre los procesos biológicos en la vida, por lo que se mudó a la Universidad de Heidelberg para estudiar medicina con Ludolf Krehl. Desde 1907 hasta 1932, Krehl fue profesor y director de la clínica médica de la Universidad de Heidelberg. Aquí Otto trabajó en el proceso de oxidación. Su especial interés en la investigación de procesos vitales por métodos físicos y químicos condujo a intentos de relacionar estos procesos con fenómenos del mundo inorgánico. Sus métodos incluyeron estudios detallados sobre la asimilación de dióxido de carbono en las plantas, el metabolismo de los tumores y los componentes químicos del fermento respiratorio de transferencia de oxígeno. Durante sus 8 años en Heidelberg, publicó 30 artículos importantes.
En 1911, Otto obtuvo su título de Doctor en Medicina en la Universidad de Heidelberg. En 1913, regresó a Berlín, donde se fundó el Instituto Kaiser Wilhelm (y donde su mentor anterior, Emil Fischer, fue vicepresidente).

Edificio principal de la Universidad de Heidelberg - Construido en 1905
Para realizar las mediciones técnicas y exactas con oxígeno necesarias para sus experimentos de fermentación, el Dr. Warburg obtuvo un manómetro. Un manómetro es simplemente un dispositivo que mide presiones. Después de ver el "manómetro de gases en sangre" Haldane-Barcroft en una breve visita al laboratorio de Joseph Barcroft en Cambridge, el Dr. Warburg comenzó a usar este instrumento. Esto difería de los manómetros anteriores en que un dispositivo especial mantenía constante el volumen del espacio de gas, de modo que la presión era la única variable cuando se formaba o eliminaba un gas a temperatura constante. El Dr. Warburg lo adaptó ingeniosamente para medir las tasas de intercambio de gases. Por lo tanto, una ventaja especial de la técnica manométrica de Warburg sobre otros métodos manométricos fue que midió los incrementos directamente, mientras que los otros procedimientos analíticos midieron las diferencias. Por lo tanto, la presencia de cualquier cantidad de O2 o CO2 no afectó la precisión de las mediciones.
La manometría se convirtió en un factor clave en el descubrimiento de la fermentación con ácido láctico del tejido canceroso, en gran parte del trabajo sobre respiración celular, fermentación y fotosíntesis, así como en la identificación de la estructura de porfirina de hierro de la enzima de la respiración celular que transfiere oxígeno. . El manómetro de Warburg también se usó para medir la emisión de CO2, que es equivalente a la producción de ácido láctico, a partir de tampones que contienen bicarbonato. Estas contribuciones fueron fundamentales para su investigación sobre el metabolismo y la fisiología del cáncer, que se describen en una colección de sus primeros trabajos.
En la década de 1940, algunos aspectos de la manometría comenzaron a ser reemplazados por técnicas espectrofotométricas, pero esto fue nuevamente el resultado de los descubrimientos fundamentales del ingeniero metodológico del Dr. Warburg. Fue el Dr. Warburg quien desarrolló desde 1928 en adelante el uso de la célula fotoeléctrica y el suministro de fuentes adecuadas de luz monocromática, en primera instancia para su medición del espectro de acción de la "enzima de respiración que transfiere O2". Mucho más tarde, en la década de 1940, estos principios se incorporaron a los espectrofotómetros comerciales, siendo el primero en comercializarse el de la compañía Beckman.
El manómetro de Warburg

Al estallar la Primera Guerra Mundial en 1914, el Dr. Warburg sintió una obligación tradicional y nacional de servir a su país, y se ofreció como voluntario (para consternación de su madre). Se unió al 2. ° Regimiento Ulanen (3. ° Escuadrón), una unidad de caballería de élite, primero sirviendo como médico y luego como ayudante de campo en la sede de la 202a División de Infantería. Sirvió en Francia y en el Frente Oriental en la actual Estonia y Lituania. El Dr. Warburg fue herido en 1917, posiblemente durante la batalla por Riga, y recibió la Cruz de Hierro de Primera Clase.
Primera Guerra Mundial

La Cruz de Hierro es una antigua decoración militar en el Reino de Prusia, y más tarde en el Imperio alemán y la Alemania nazi.
Después de que fue herido, la madre del Dr. Warburg insistió en que su hijo podría servir mejor a su país no volviendo al campo de batalla, sino volviendo a la ciencia académica. Entonces le escribió a su amigo Albert Einstein, pidiéndole que usara su influencia para convencer a su hijo. Einstein cumplió; El Dr. Warburg buscó la liberación del servicio activo, que fue aprobado en el verano de 1918.
El Dr. Warburg regresó a Berlín, y a un banco de laboratorio en el Instituto Kaiser Wilhelm. Como investigador principal en el nuevo Instituto de Biología, era libre de elegir su tema de investigación. Como la financiación de la República de Weimar era limitada, el hecho de que su propuesta de investigación de una frase recibiera fondos completos demuestra la reputación científica del Dr. Warburg.
A los pocos años de su regreso de la Primera Guerra Mundial, surgieron tres líneas principales de investigación, que ocuparon al Dr. Warburg desde 1919 hasta su muerte en 1970: la fotosíntesis, el cáncer y la naturaleza química de las enzimas responsables de las transformaciones de energía biológica (es decir, oxidaciones y reducciones). En los tres, avanzó mucho las metodologías e hizo descubrimientos fundamentales.

Solicitud a la Notgemeinschaft der Deutschen Wissenschaft ( Asociación de Emergencia de la Ciencia Alemana , precursora de la Deutsche Forschungsgemeinschaft) . La solicitud consistió en una sola oración, "Requiero 10,000 marcas" y fue totalmente financiada.
En 1923, Otto Warburg y Seigo Minami publicaron las primeras observaciones sobre los cambios en el metabolismo de los tumores. Habían observado que los tumores acidificaron la solución de Ringer (una solución de sal isotónica, con NaHCO3 2,4 mM) cuando se agregó glucosa 13 mM, como lo indica un cambio en el color de los indicadores orgánicos de pH. En esta solución acidificada, el ácido láctico se identificó químicamente. Para cuantificar mejor este fenómeno, Otto Warburg modificó el manómetro Barcroft para medir cortes de un hepatoma de rata Flexner-Jobling, que había recibido de Rhoda Erdmann en el Instituto Rockefeller. La cantidad de lactato producido se calculó a partir del aumento en la formación de CO2 durante un período de incubación de 30 minutos. Sorprendentemente, el tejido tumoral tenía una tasa de formación de lactato 70 veces mayor que el hígado normal, así como también el tejido renal y cardíaco analizado.
Esta es la observación que más de 50 años después se conocería como el efecto Warburg . Descubrió que la producción de lactato a partir de la glucólisis no dependía de la presencia de oxígeno. Eso no se esperaba, ya que según Pasteur, la presencia de oxígeno debería haber suprimido la glucólisis. El hecho de que parecía no haber una relación directa entre la respiración y la glucólisis llevó a la conclusión de que en las células cancerosas, la glucólisis era una reacción que podía producir energía, independiente de la respiración (consumo de oxígeno). En otros experimentos con concentraciones variables de glucosa y bicarbonato, se demostró que no había una diferencia generalizable en el consumo de oxígeno entre el tumor y el tejido epitelial normal respectivo.
En 1924, el Dr. Warburg planteó la hipótesis de que había un defecto en la relación entre la glucólisis y la respiración. Aunque esta observación fue corroborada con otros tumores por varios científicos contemporáneos, la observación de que el oxígeno no podía suprimir la glucólisis lo llevó a proponer que un daño en la respiración conduce a la carcinogénesis. Esto llegó a ser un tema muy controvertido que culminó en sus famosos artículos en Science en 1956.
Al probar los efectos de otros parámetros, el Dr. Warburg y sus compañeros de trabajo cambiaron el pH de la solución de Ringer que varía de pH 7,83 a 6,66 usando mezclas de gases de CO2-N2 al 1-15%, respectivamente. La tasa de producción de CO2 (interpretada como glucólisis) aumentó con el aumento del pH alcalino. Además, un aumento de diez veces en la concentración de bicarbonato a un pH definido de 7.5 también aumentó la producción de CO2. Warburg interpretó estas condiciones como las de la sangre que pasa a través de los capilares, lo que lleva al mismo tiempo a una acidificación moderada y a un aumento en la concentración de bicarbonato. En el balance, la glucólisis de los tejidos no cambiaría. Por otro lado, otros estudios mostraron que en los homogeneizados de tejidos, la alcalinidad aumentó con la desdiferenciación y la necrosis de los tumores, lo que sugiere que el tumor en sí puede tener un pH diferente. Sin embargo, la influencia del pH en el crecimiento de las células tumorales nunca pareció ser de interés para el Dr. Warburg, a pesar de su interés en los sistemas de transferencia de hidrógeno como las coenzimas NAPDH y NADH, que condujeron a la caracterización de la actividad de la mayoría de los glucolíticos. enzimas en años posteriores.
Primeras observaciones sobre el metabolismo tumoral
Primera nominación al Premio Nobel
El Dr. Warburg fue nominado para el Premio Nobel en 1926, pero el comité decidió otorgarlo a Johannes Fibiger por sus hallazgos sobre una condición de crecimiento de tejido gástrico que se cree que es un cáncer inducido por un nematodo (carcinoma de espirópteros), hallazgos que luego resultaron ser falso
Estudios de hierro y cobre
En 1927, el Dr. Warburg diseñó un método para determinar cantidades traza (10 - 4 mg) de hierro (Fe) y cobre (Cu) basado en los efectos catalíticos de estos iones en la oxidación de la cisteína por el oxígeno molecular. Con estos métodos, estableció los hechos básicos relacionados con la presencia en el material biológico de hierro y cobre libres o "sueltos" (es decir, Fe y Cu que se quelan fácilmente con cisteína). Descubrió que Fe y Cu están regularmente presentes en el plasma sanguíneo humano y animal y que sus concentraciones en condiciones normales son tan constantes como lo son otros componentes sanguíneos. Estableció el rango normal (que para Cu y Fe es del orden de 1 mg / litro) y descubrió que la concentración de cobre aumenta en el embarazo, las infecciones y las anemias por deficiencia de hierro y que el contenido de Fe cae en las anemias por deficiencia de hierro. Este trabajo fue el punto de partida para la aplicación clínica de la determinación de Fe y Cu en suero o plasma humano, una cuestión de importancia diagnóstica, especialmente en la enfermedad de Wilson, donde el contenido de Cu está muy disminuido.
La fermentación es el proceso metabólico por el cual se produce energía en ausencia de O2 a través de la oxidación de compuestos orgánicos, típicamente azúcares, a compuestos orgánicos más simples, como el piruvato. El piruvato se procesa posteriormente en etanol por fermentación alcohólica o ácido láctico por fermentación de lactato.
El Dr. Warburg estaba interesado en la base química del "fermento respiratorio" responsable de la transferencia de oxígeno en las células. Ya había postulado en 1914 que el hierro tenía una función catalítica en la respiración celular. Al visitar el laboratorio de Warburg, Alan Hill le hizo notar que la inhibición de la respiración por CO era sensible a la luz.
Por lo tanto, el Dr. Warburg descubrió que la inhibición de la respiración por el monóxido de carbono (CO) puede revertirse con la luz. Al estudiar el consumo de O2 por las células de levadura en presencia de CO en la fase gaseosa, desarrolló un método basado en la recuperación fotoquímica de la respiración por disociación del CO unido a la enzima respiratoria. Haldane y Lorrain-Smith habían demostrado años antes la fotosensibilidad del aducto entre la hemoglobina y el CO.
El efecto de la luz, que permitió al Dr. Warburg revelar que el hemo es el grupo protésico de la enzima respiratoria, se debe al rendimiento cuántico mucho más alto de fotodisociación de CO en comparación con el O2 unido a proteínas de hemo reducidas. Al medir la tasa de recuperación de la respiración en función de la longitud de onda de la luz irradiada en presencia de mezclas variables de O2 y CO, Warburg y Negelein determinaron el espectro de acción fotoquímica de la enzima respiratoria: citocromo-c-oxidasa. Es notable ver el espectro de citocromo-c-oxidasa determinado hace tantos años, con tanta precisión.
Hoy, sabemos que de hecho hay cinco proteínas con hierro para el transporte de electrones y que la citocromo-c-oxidasa oxidasa es parte del complejo IV. Además, el Dr. Warburg postuló que las proteínas respiratorias se localizarían en la "grana" de las células, que años más tarde se identificaron como mitocondrias. En un artículo publicado en 1928, The Chemical Constitution of Respiration Ferment, describió los "fermentos" esenciales involucrados en la respiración celular.
El fermento respiratorio y la citocromo-c-oxidasa
Instituto Kaiser Wilhelm y El Premio Nobel

Otto Warburg en su laboratorio en el Instituto de Biología Kaiser Wilhelm en Berlín-Dahlem en 1931. Bundesarchiv (Archivos Federales Alemanes) Bild 102–12525, fotógrafo desconocido.
El Dr. Warburg detestaba el turismo académico y creía que era una pérdida de tiempo. Pero sí hizo dos visitas a los Estados Unidos en la década de 1920, visitas que tuvieron profundas consecuencias en su carrera. En la primera ocasión en 1924, visitó a Jacob Loeb, un amigo de la familia Warburg, en el Rockefeller Institute de Nueva York. También dio charlas en otras universidades. En 1929, fue invitado en el laboratorio de Barron en la Escuela de Medicina Johns Hopkins, donde realizó experimentos sobre la naturaleza enzimática de las reducciones químicas en las células sanguíneas.
En esta visita, con el apoyo de Jacob Loeb, también negoció con la Fundación Rockefeller para establecer institutos de investigación en Alemania. Sugirió la construcción de un pequeño instituto de fisiología celular, así como un instituto más grande de física bajo la dirección de Max von Laue. Imaginó colaborar con físicos especialmente en el campo de la radiación (la aplicación de la radiación a problemas bioquímicos había sido una fuente importante de sus éxitos recientes).
En seis meses, la Fundación Rockefeller proporcionó 635,000 marcos para la compra del terreno requerido para los dos institutos, 600,000 marcos para la construcción y equipamiento del instituto de fisiología celular, y alrededor de 1.5 millones de marcos para un instituto de física, todo bajo el ala del Kaiser Wilhelm Gesellschaft. El Instituto de Fisiología Celular se inauguró en diciembre de 1931, y Otto Warburg fue su único director.
El Dr. Warburg investigó más a fondo el metabolismo de los tumores y la respiración de las células, y en 1931 finalmente fue galardonado con el Premio Nobel de Fisiología por desentrañar el fermento de respiración de transferencia de oxígeno y por su descubrimiento de la naturaleza y el modo de acción de la enzima respiratoria. - citocromo C oxidasa (CcO). El premio llegó después de recibir 46 nominaciones durante un período de nueve años a partir de 1923, trece de los cuales fueron presentados en 1931, año en que ganó el premio. Su padre se había perdido este evento por solo unos meses, después de haber muerto en julio.
A mediados y finales de la década de 1930, algunos aspectos de la manometría que el Dr. Warburg utilizó en su investigación comenzaron a ser reemplazados por técnicas espectrofotométricas. Junto con el físico Manfred von Ardenne, el Dr. Warburg mejoró la sensibilidad del espectrómetro, lo que le permitió medir los espectros de absorbancia de luz de los nucleótidos de piridina. El descubrimiento de diferencias en las líneas espectrales con el estado de hidrogenación abrió nuevas posibilidades para medir y determinar la actividad de las reacciones enzimáticas. Esto implicó la transferencia de hidrógenos moleculares desde o hacia estos nucleótidos de piridina.
Durante los siguientes 10 años, utilizando este ensayo espectrográfico, el Dr. Warburg fue el primero en cristalizar y caracterizar 9 de las 13 enzimas glucolíticas ahora conocidas por las reacciones que catalizaron. En la nomenclatura ahora aceptada, estas enzimas glucolíticas eran deshidrogenasa láctica, enolasa, aldolasa, deshidrogenasa de gliceraldehído-fosfato, 3-fosfoglicerato quinasa, alcohol deshidrogenasa, piruvato quinasa, a-glicerofosfato deshidrogenasa y triosa fosfato isomerasa. Estas son todas las enzimas clave actualmente en estudio en el metabolismo del cáncer. Otras mejoras técnicas en el fotómetro en cooperación con Beckman Instruments, con sede en California, hicieron que el dispositivo estuviera disponible comercialmente, y esta prueba óptica se convirtió en una herramienta enzimática y analítica mundial.

Premio Nobel de Fisiología - 1931
Cuando el Partido Nacional Socialista Alemán de los Trabajadores (o Partido Nazi) llegó al poder a principios de la década de 1930, las personas de ascendencia judía se vieron obligadas a abandonar sus puestos profesionales. Bajo la Reichsbürgergesetz (Ley de ciudadanía del Reich de 1935), los nazis consideraban al Dr. Warburg un Halbjude (medio judío). (Su madre era protestante; su padre, que se había convertido al protestantismo, era de herencia judía). Aunque se le prohibió la enseñanza, al Dr. Warburg se le permitió continuar su investigación.
La mayor parte de la familia extendida de Warburg escapó de la persecución nazi. La Dra. Betty Warburg y su madre Gerta, sin embargo, perecieron en el campo de Sobibor en el distrito de Lublin en Polonia. Una prima, Helen, falleció en Auschwitz, y otra prima, María, nunca abandonó el Centro de Eutanasia de Brandeburgo. Las tres hermanas del Dr. Warburg sobrevivieron casándose con miembros de la alta sociedad alemana y convirtiéndose al cristianismo.
En 1941, el Dr. Warburg perdió su puesto brevemente cuando hizo comentarios críticos sobre el régimen nazi. A lo largo de su vida, en general, se mantuvo apolítico, centrándose en cambio en sus experimentos y escritos de laboratorio.
Unas semanas después de perder su puesto, una orden personal de la Cancillería de Hitler le ordenó reanudar el trabajo en su investigación sobre el cáncer (aparentemente su investigación era demasiado valiosa para perderla). En 1942, fue nombrado miembro de un comité nacional encargado de combatir el cáncer, una enfermedad que Hitler temía morbosamente.
En 1943, cuando los ataques aéreos hicieron que la vida en Berlín fuera peligrosa, el Dr. Warburg, junto con su personal y equipo, se trasladó a unas 30 millas al noroeste a la finca Liebenberg, que el Príncipe Eulenberg, un noble prusiano, había puesto a su disposición. Aquí su trabajo continuó sin interrupciones hasta 1945, cuando los rusos que avanzaban ocuparon el área y confiscaron todo su equipo de laboratorio. Aunque nadie descubrió quién fue el responsable de esta acción, el comandante en jefe ruso, Marshall Zhukov, invitó posteriormente al Dr. Warburg a verlo y le dijo, en nombre del gobierno ruso, que el desmantelamiento de su laboratorio había estado en error Se emitieron órdenes para devolver su aparato y libros, pero, por desgracia, no se pudieron rastrear.
En 1944, el Dr. Warburg fue nominado para un segundo Premio Nobel de Fisiología por Albert Szent-Györgyi, por su trabajo sobre la nicotinamida, el mecanismo y las enzimas involucradas en la fermentación y el descubrimiento de flavina (en enzimas amarillas). Según algunas fuentes, fue galardonado con este segundo Nobel, pero no pudo aceptarlo debido a un decreto de Hitler de 1937 que impedía a los alemanes aceptar el premio. De todos modos, el Dr. Warburg continuó su línea de investigación sobre la "transferencia de hidrógeno de enzimas celulares" e incluso atrajo una tercera nominación al Nobel que fue altamente politizada.
Desafortunadamente, gran parte de su investigación fue interrumpida durante los últimos años de guerra.
A lo largo de la década de 1940, el Dr. Warburg practicó sus propias recomendaciones para mantener un estilo de vida disciplinado. Cultivó sus propios vegetales, sacó agua de un pozo no contaminado, hizo que su pan se horneara con granos de trigo no tratado con pesticidas y mantuvo sus propias aves de corral. También se mantuvo activo haciendo deportes, dando largas caminatas y cabalgatas. Después de que su hermana favorita, Lotte, muriera de cáncer en 1948, el Dr. Warburg dejó de fumar.
Segunda Guerra Mundial

Después de la guerra, pasaron algunos años hasta que el Dr. Warburg pudiera regresar a condiciones de trabajo aceptables. También fue investigado por su papel en la Alemania nazi. Aunque el cuartel general de las fuerzas armadas alemanas clasificó al instituto de Warburg como crucial para el esfuerzo de guerra, el Dr. Warburg luego refutó que había realizado alguna vez una investigación relacionada con la guerra. Finalmente fue readmitido en la comunidad científica internacional.
Años de posguerra, invenciones y elogios
Otto Warburg con colegas alemanes y estadounidenses en la Institución Oceanográfica Woods Hole, EE. UU. En 1949. De izquierda a derecha: Saul Korey, David Nachmansohn, Dean Burk, Albert Szent-Györgyi, Otto Warburg, Otto Meyerhof, Carl Neuberg y George Wald.


Algunos de los trabajos del Dr. Warburg, aunque tenían como único objetivo obtener conocimiento de las leyes de la naturaleza, tuvieron otras consecuencias prácticas y económicas de gran alcance. Su descubrimiento de la nicotinamida como componente celular en 1935 llevó a Conrad Elvehjem a su identificación como la vitamina anti-pelagra, para prevenir y curar la pelagra. Más tarde, los efectos inhibitorios de la nicotinamida en las micobacterias responsables de la lepra y la tuberculosis llevaron al descubrimiento de que su primo químico, la hidrazida de ácido isonicotínico (isoniazida), es aún más eficaz que la nicotinamida. Este medicamento ahora se usa ampliamente para controlar la tuberculosis.
Para 1952, con numerosos reconocimientos que le otorgaron, a menudo fue invitado a dar conferencias en Europa y Estados Unidos. Además, a pesar de la censura internacional durante la guerra, su membresía en la Royal Society (se convirtió en miembro en 1934) nunca fue revocada. De hecho, el Dr. Warburg recibió un doctorado honorario de la Universidad de Oxford. Finalmente fue elegido miembro de la Academia de Ciencias (restablecida en Berlín Oriental), uniéndose a las filas de su padre, Albert Einstein y Max Planck.
Durante el último período de su vida, el Dr. Warburg continuó trabajando tanto en la fotosíntesis como en el metabolismo tumoral, particularmente en el papel de las alteraciones del ciclo de la glucólisis en la tumorigénesis. Continuamente buscó medios para mejorar la cuantificación en la investigación biológica y escribió prolíficamente. Sus publicaciones fueron innovadoras, porque el Dr. Warburg utilizó enfoques físicos y químicos cuantitativos para investigar el rápido crecimiento de las células cancerosas.
En los años de la posguerra, el Dr. Warburg recibió ofertas de trabajo de varios países diferentes (incluidos Rusia y los Estados Unidos) y de varias ciudades alemanas.
Finalmente, en 1948, viajó a los Estados Unidos, aceptando invitaciones del Dr. Robert Emerson, profesor de botánica en la Universidad de Illinois, y el Dr. Dean Burk en el Instituto del Cáncer en Bethesda para realizar experimentos de fotosíntesis en sus laboratorios. Al regresar a Berlín en 1950, trabajó en el Instituto Kaiser Wilhelm (que en 1952 se convirtió en un Instituto Max Planck), donde continuó trabajando hasta su muerte en 1970.
Después de su trabajo anterior, en los años 50 y 60, el Dr. Warburg estudió cómo puede surgir la glucólisis aeróbica de las células cancerosas. Encontró que los fibroblastos en el cultivo de tejidos se convierten en células de fibrosarcoma cuando se exponen repetidamente durante cortos períodos a baja presión de oxígeno. El Dr. Warburg demostró que las células embrionarias de ratón adquieren las características metabólicas de las células cancerosas en el cultivo de tejidos a baja presión de oxígeno en 48 horas (es decir, en el curso de dos divisiones celulares). Lo más importante, si se restablece la presión de oxígeno normal, el metabolismo del cáncer permanece y apoya el crecimiento.
El Dr. Warburg continuó afirmando su hipótesis sobre la causa del cáncer, alegando que "la respiración de todas las células cancerosas está dañada". Su famoso artículo publicado en 1956 en Science , titulado Sobre el origen de las células cancerosas , desencadenó años de controvertido debate. Muchos investigadores argumentaron que los hallazgos de Warburg realmente identificaron los efectos (y no las causas) del cáncer, ya que no se pudieron encontrar defectos mitocondriales que estuvieran constantemente asociados con la transformación maligna en los cánceres (en ese momento).
Finalmente, su teoría de que el cáncer comienza con una lesión irreversible en la respiración celular finalmente cayó en desgracia en medio de investigaciones que apuntan a mutaciones genómicas como la causa del crecimiento celular descontrolado.
En pocas palabras, según el Dr. Warburg, la causa principal del cáncer es el reemplazo de la respiración de oxígeno en las células normales del cuerpo por una fermentación de azúcar. Todas las células normales del cuerpo satisfacen sus necesidades energéticas mediante la respiración de oxígeno, mientras que las células cancerosas satisfacen sus necesidades energéticas en gran parte mediante la fermentación.
Presentó estos conceptos en prestigiosas reuniones, una de ellas fue la Reunión Anual de los Premios Nobel en 1966 en Lindau, una isla en el lago de Constanza (Alemania). Aquí todavía enfrentaba mucha disidencia científica. Su idea de que lo que permitió la proliferación de las células cancerosas fue la energía a nivel respiratorio se enfrentó a descubrimientos más recientes que se centraron en la genética alterada de las células cancerosas que conducen al crecimiento tumoral.
La respiración de todas las células cancerosas está dañada.
-Otto Heinrich Warburg

Warburg articuló su hipótesis en un documento titulado "La causa principal y la prevención del cáncer", que presentó en una conferencia en la reunión de premios Nobel el 30 de junio de 1966 (Lago de Constanza).

La importancia del descubrimiento del Dr. Warburg todavía es evidente en la prueba de diagnóstico de cáncer común que utiliza tomografía de emisión de positrones (PET) con flúor-18 fluorodeoxiglucosa (FDG) que tiene una alta precisión diagnóstica. La solución clásica de escaneo PET utilizada es una variante de glucosa regular que está etiquetada con un marcador radiactivo para que pueda ser detectada por el escáner PET. Las células normales absorben glucosa a una tasa basal relativamente baja. Sin embargo, las células cancerosas, como se describió anteriormente, usan rápidamente la glucosa. Estas células de glucosa marcadas se acumulan en el tejido canceroso y se consideran sitios activos de crecimiento del cáncer.
PET Scan que detecta el cáncer de pulmón
En sus últimos años, el Dr. Warburg se convenció más de que la mayoría de las enfermedades son el resultado de la contaminación o las toxinas ambientales (xenobióticos). Esto llevó a un enfoque apasionado en su salud y dieta. Cuando visitaba restaurantes, traía consigo sus propias bolsas de té. También hizo todo lo posible para obtener mantequilla orgánica, en la cual confiaba.
Ya en 1923, Warburg y Schoeller discutieron el cáncer de hambre por medicamentos que conducen a la "privación nutricional". En su última publicación en 1970, (Entstehung von Krebsstoffwechsel durch Vitamin-B1-Mangel Thiaminmangel), el Dr. Warburg afirmó que la causa del "metabolismo tumoral" espontáneo era la falta de oxígeno o la falta de vitamina B1 (tiamina). Sostuvo que ambas condiciones aumentan la producción de ácido láctico. Esta línea de pensamiento lo llevó a considerar la administración de suplementos vitamínicos específicos, que mejorarían la oxidación celular. Por lo tanto, creía que el cáncer podría prevenirse o tratarse nutricionalmente manteniendo una dieta adecuada y rica en nutrientes orgánicos.
El Dr. Warburg nunca se casó, pero tuvo numerosos amigos y fue acompañado fielmente por su antiguo compañero Jakob Heiss. Según la mayoría de las cuentas, nunca mostró ningún interés en una vida social típica. Al igual que su padre antes que él, el Dr. Warburg residió en su Instituto, trabajando semanas de 6 días en problemas de fisiología celular, particularmente relacionados con el metabolismo, el cáncer y la fotosíntesis. De vez en cuando solo permitía que su amor por montar a caballo interrumpiera su investigación. En 1968, sufrió un fémur roto. Esto se complicó por trombosis venosa profunda. Murió el 1 de agosto de 1970 (a la edad de 86 años) de una embolia pulmonar y fue enterrado en un cementerio cristiano.

El Dr. Warburg era conocido por citar un aforismo que atribuyó a Max Planck:
La ciencia avanza un funeral a la vez.
El Dr. Otto Warburg fue un investigador pionero en bioquímica que hizo contribuciones sustanciales a nuestra comprensión temprana del metabolismo del cáncer. Fue galardonado con el Premio Nobel de Fisiología en 1931 por su descubrimiento de la enzima respiratoria citocromo c oxidasa (CcO), que reside en la membrana mitocondrial interna.
El Dr. Warburg demostró que los cánceres con frecuencia dependen menos de las mitocondrias y obtienen hasta el 50% de su ATP al metabolizar la glucosa directamente en ácido láctico, incluso en presencia de oxígeno. Este fenotipo frecuente de cáncer se conoció como el "efecto Warburg".
Los defectos en los complejos de fosforilación oxidativa mitocondrial, la bioenergética alterada y un cambio metabólico a la fermentación a menudo se ven en los cánceres. La investigación del Dr. Warburg ahora ha demostrado que un defecto en un componente mitocondrial de transporte de electrones, la citocromo c oxidasa, conduce a un aumento de la glucólisis y la carcinogénesis.
El Dr. Warburg fue un modelo a seguir para la investigación meticulosa, contribuyendo mucho a nuestro conocimiento de la mejor manera de diagnosticar y tratar el cáncer.
El metabolismo de la glucosa, el macronutriente central, permite aprovechar la energía en forma de adenosina trifosfato (ATP) a través de la oxidación de sus enlaces de carbono. Este proceso es esencial para mantener toda la vida de los mamíferos. En los mamíferos, el producto final puede ser lactato o, tras la oxidación total de glucosa a través de la respiración en las mitocondrias, CO2. En tumores y otras células en proliferación o en desarrollo, la tasa de absorción de glucosa aumenta dramáticamente, y se produce lactato, incluso en condiciones completamente oxigenadas. Este proceso ahora se conoce como el efecto Warburg o se describe brevemente como glucólisis aeróbica .
La glucólisis es una vía metabólica que ocurre en el citoplasma celular e involucra una secuencia de diez reacciones enzimáticas. Estas reacciones convierten la glucosa en piruvato y producen los compuestos de alta energía ATP y dinucleótido de nicotinamida y adenina (NADH).
El Dr. Warburg descubrió que la producción de lactato no depende de la presencia de oxígeno. Eso no se esperaba, ya que según Pasteur, la presencia de oxígeno debería haber suprimido la glucólisis. Esto se conoce como el efecto Pasteur (observación de Pasteur de que las células de levadura consumen menos azúcar cuando se cultivan en presencia de O2 que cuando se cultivan en ausencia de este).
El hecho de que parecía no haber una relación directa entre la respiración y la glucólisis llevó a la conclusión de que en las células cancerosas, la glucólisis era una reacción que podía producir energía, independiente de la respiración (consumo de oxígeno). En otros experimentos con concentraciones variables de glucosa y bicarbonato, se demostró que no había una diferencia generalizable en el consumo de oxígeno entre el tumor y el tejido epitelial normal respectivo.
La observación del Dr. Warburg fue que la mayoría de las células cancerosas producen predominantemente energía mediante una alta tasa de glucólisis seguida de fermentación de ácido láctico en el citosol, en lugar de una tasa relativamente baja de glucólisis seguida de oxidación de piruvato en la mitocondria como en la mayoría de las células normales. El último proceso es aeróbico (usa oxígeno).
Las células tumorales malignas y de rápido crecimiento suelen tener tasas glucolíticas hasta 200 veces más altas que las de sus tejidos de origen normales; Esto ocurre incluso si el oxígeno es abundante. En la mayoría de las células no cancerosas, por otro lado, la fermentación no ocurrirá si hay suficiente oxígeno.
El efecto Warburg

A principios de la década de 1970, el bioquímico austriaco Efraim Racker acuñó por primera vez la glucólisis aeróbica de las células cancerosas con el efecto Warburg . El Dr. Racker desarrolló sus propias teorías sobre los orígenes del efecto Warburg que van desde desequilibrios en el pH intracelular hasta defectos en la actividad ATPasa.
Esencialmente, lo que se conoce como el efecto Warburg denota un fenotipo metabólico típico de muchas células tumorales, a saber, la alta actividad de la glucólisis aeróbica, es decir, la producción de ácido láctico, incluso en presencia de suficiente oxígeno. El Dr. Warburg intentó ampliar las implicaciones de este proceso metabólico a una teoría general para el desarrollo del cáncer.
Para el Dr. Warburg, el inicio de la fermentación a nivel celular es la causa principal del cáncer ("die letzte Ursache"). Sugirió que las células se conviertan en células cancerosas al cambiar de la respiración a la fermentación y postuló que este cambio en el metabolismo es una causa fundamental de cáncer. Por lo tanto, en lugar de respirar por completo en presencia de oxígeno adecuado, las células cancerosas fermentan la glucosa. En resumen, las células cancerosas reconectan su metabolismo para promover el crecimiento, la supervivencia, la proliferación y el mantenimiento a largo plazo. La característica común de este metabolismo alterado es el aumento de la absorción de glucosa y la fermentación de glucosa a lactato.
El efecto Warburg es ahora un término utilizado para describir dos observaciones no relacionadas en oncología y fisiología de las plantas, ambas del trabajo del Dr. Warburg. En oncología, el efecto Warburg se refiere a la alta tasa de glucólisis y fermentación de lactato en el citosol exhibida por la mayoría de las células cancerosas, en relación con la tasa relativamente baja de glucólisis y oxidación del piruvato en las mitocondrias exhibidas por la mayoría de las células normales. Por lo tanto, el efecto Warburg es el reverso del efecto Pasteur (la inhibición de la fermentación por O2) exhibido por las células cancerosas. La alteración del efecto Pasteur en el cáncer está relacionada con las prolil hidroxilasas y el factor inducible por hipoxia. En fisiología vegetal, el efecto Warburg es la inhibición de la fijación fotosintética de CO2 por altas concentraciones de O2.
Este descubrimiento llegó a ser un tema muy controvertido en la bioquímica culminante en su famoso artículo en Science en 1956 - Sobre el origen de las células cancerosas.

En las últimas dos décadas, los descubrimientos de oncogenes y genes supresores de tumores han creado un paradigma en el que las alteraciones genéticas autónomas de las células se perciben como una fuerza impulsora primaria para la transformación neoplásica. Las alteraciones oncogénicas del metabolismo celular se consideraron epifenómenos. Sin embargo, con los descubrimientos de mutaciones oncogénicas en las enzimas metabólicas mitocondriales, como la fumarato hidratasa, la succinato deshidrogenasa y la isocitrato deshidrogenasa 2, ahora no es correcto negar el papel del metabolismo en la tumorigénesis.
El Dr. Warburg razonó que la respiración debe dañarse en los cánceres porque los altos niveles de O2 no pueden suprimir la producción de ácido láctico por las células cancerosas. Aunque las observaciones de Chance y Weinhouse en la década de 1950 inicialmente negaron la afirmación del Dr. Warburg de defectos mitocondriales en los cánceres, muchos estudios en las últimas décadas han documentado mutaciones oncogénicas de ADN nuclear y mitocondrial en proteínas involucradas en la respiración. Por lo tanto, el efecto Warburg podría surgir de mutaciones en el ADN de las mitocondrias y la respiración defectuosa. Sin embargo, la glucólisis aeróbica también puede ocurrir simultáneamente con la respiración mitocondrial. Visto desde la perspectiva de la energía celular contemporánea, estas células cancerosas recientemente transformadas poseen un mecanismo "ineficiente" para producir ATP que favorece la glucólisis aeróbica y la producción de lactato en el citosol en lugar de que la oxidación de glucosa progrese a través de la fosforilación oxidativa mitocondrial.
Queda la pregunta de por qué ocurre esto.
Defectos mitocondriales y el efecto Warburg (ayer y hoy)
Posibles beneficios de la glucólisis aeróbica en células cancerosas
El aumento de la glucólisis puede proporcionar algunas ventajas a las células cancerosas. La principal ventaja o función es que parte de este cambio metabólico permite que el piruvato y el lactato generados por la glucólisis se dirijan hacia la biosíntesis, que es importante para la proliferación (crecimiento) celular del cáncer. Las células cancerosas productoras de lactato se caracterizan por un aumento de la glucólisis aeróbica y una formación excesiva de lactato.
En los cánceres lactagénicos, los oncogenes y las mutaciones supresoras de tumores se comportan de manera altamente orquestada, aparentemente con el propósito de aumentar la utilización de glucosa para propósitos de lactagénesis y el intercambio de lactato entre, dentro y entre las células.
Se identifican cinco pasos principales:
aumento de la captación de glucosa;
aumento de la expresión y actividad de la enzima glucolítica;
disminución de la función mitocondrial;
aumento de la producción, acumulación y liberación de lactato; y
upregulation de transportadores de monocarboxilato MTC1 y MCT4 para el intercambio de lactato. El lactato es probablemente el único compuesto metabólico involucrado y necesario en todas las secuelas principales de carcinogénesis, específicamente: angiogénesis, escape inmune, migración celular, metástasis y metabolismo autosuficiente. Además, el exceso de lactato se suma a un terreno extracelular ácido que puede ayudar a las células cancerosas a sobrevivir y crecer.

La investigación incluso ha sugerido que la glucólisis aeróbica puede ayudar a las células cancerosas a evitar ser reconocidas y destruidas por las células del sistema inmune. Los cambios en el entorno metabólico pueden impedir que las células inmunes encuentren células cancerosas e incluso atraer células que pueden ayudar al crecimiento de las células tumorales. Los cambios metabólicos inusuales observados en las células cancerosas también pueden activar oncogenes que permiten que las células cancerosas eviten la muerte.
Otra explicación propuesta de por qué el microambiente tumoral selecciona un metabolismo alterado es que a medida que el tumor temprano se expande, supera los límites de difusión de su suministro de sangre local, lo que lleva a la hipoxia (falta de oxígeno) y la estabilización del factor de transcripción inducible por hipoxia ( HIF)
HIF inicia un programa transcripcional que brinda múltiples soluciones al estrés hipóxico. Debido a que una disminución de la dependencia de la respiración aeróbica se vuelve ventajosa, el metabolismo celular se desplaza hacia la glucólisis por la mayor expresión de enzimas glucolíticas, transportadores de glucosa e inhibidores del metabolismo mitocondrial. Además, el HIF estimula la angiogénesis (la formación de nuevos vasos sanguíneos) regulando al alza varios factores, incluido el factor de crecimiento endotelial vascular (VEGF) más prominente. Estos nuevos vasos sanguíneos alimentan el tumor con nutrientes de crecimiento.
Debe enfatizarse que, si bien los tumores malignos han adquirido un fenotipo glucolítico alto, mejorando su captación de glucosa en casi 10 veces, su tasa de respiración permanece esencialmente sin cambios con respecto al tejido normal circundante. Peter Pedersen y sus colegas han descubierto aún más jugadores clave subcelulares y moleculares que impulsan el tumor hacia esta transformación metabólica. Estas son hexoquinasa, varias enzimas mitocondriales asociadas y transportadores de membrana plasmática, y el orgánulo crucial involucrado en la generación de energía, la mitocondria.
Mientras mantienen su capacidad de respiración, los tumores "se vuelven más parasitarios" al mejorar su capacidad para eliminar la glucosa de su entorno. Con el exceso de glucosa a mano, los tumores desvían su flujo metabólico más hacia la glucólisis que sus células de origen normales, una estrategia que permite su supervivencia cuando el oxígeno es limitado mientras les proporciona un mecanismo para envenenar su entorno extracelular con ácido, allanando así el camino para invasión y metástasis.
Significativamente, los tumores aprovechan una enzima crucial para regular y apoyar esta ruta destructiva y para atrapar y canalizar la glucosa hacia la glucólisis. Esta enzima es una isoforma de hexoquinasa, denominada hexoquinasa tipo II o HK-2. HK2 es la primera de varias enzimas en las células cancerosas involucradas en el metabolismo de la glucosa de azúcar en ácido láctico. En su ubicación mitocondrial, HK2 se une a / cerca de la proteína VDAC (canal aniónico dependiente de voltaje), escapa a la inhibición por su producto glucosa-6-fosfato y obtiene acceso al ATP producido mitocondrial. Ayuda a inmortalizar las células cancerosas, es decir, previene su muerte celular.
Debido a las características moleculares de múltiples facetas a niveles genéticos, epigenéticos, transcripcionales y enzimáticos, incluida la localización subcelular a las mitocondrias, HK-2 facilita y promueve el fenotipo de tumor con alto contenido glucolítico. Por lo tanto, HK-2 representa un gen o enzima modelo fundamental que los tumores "seleccionan" durante la tumorigénesis para facilitar su camino destructivo.
Efecto Warburg y más allá: alentando las perspectivas de terapias efectivas
Estudios recientes han descrito cómo este flujo glucolítico aberrante puede subvertirse hacia un fenotipo metabólico más "normal", y cómo el flujo glucolítico afecta el microambiente tumoral para facilitar la metástasis tumoral. A partir de este modelo, se han propuesto varias estrategias de direccionamiento metabólico que pueden debilitar selectivamente los tumores. Según el Dr. Pedersen y sus colegas, una primera opción obvia es bloquear los pasos iniciales de la glucólisis para evitar que avance más allá del paso de fosforilación mediado por la hexoquinasa.
Un ejemplo de esto es el inhibidor de la hexoquinasa llamado 3-bromopiruvato (3-BP). Young Hee Ko y sus colegas han probado con éxito 3-BP en ensayos preclínicos contra tumores malignos y han demostrado que es especialmente eficaz para erradicar tumores avanzados en 19/19 animales, sin dañar a los animales y sin el retorno de los tumores durante sus vidas. Esta investigación en el área de los inhibidores de HK-2 está más allá de esta biografía, pero está demostrando ser una terapia contra el cáncer muy prometedora.
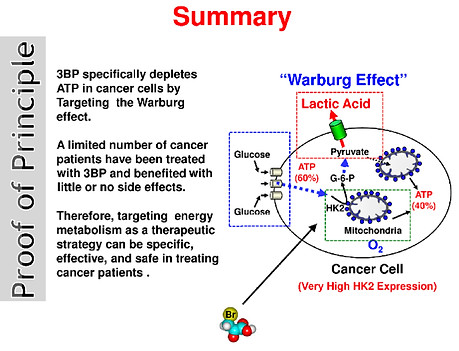

Otra estrategia de tratamiento contra el cáncer de uso común basada en el control de la glucólisis y el efecto Warburg es la dieta cetogénica. Esto requiere minimizar los carbohidratos y reemplazarlos con grasas saludables y cantidades moderadas de proteínas de alta calidad. La justificación para proporcionar una dieta rica en grasas y baja en carbohidratos en la terapia contra el cáncer es reducir los niveles circulantes de glucosa e inducir cetosis de manera que las células cancerosas no tengan energía mientras que las células normales adaptan su metabolismo para usar cuerpos cetónicos y sobrevivir. Además, también reduce los niveles de glucosa en sangre, lo que hace que la insulina y el factor de crecimiento similar a la insulina (importantes impulsores de la proliferación de células cancerosas) también disminuyan. Basado en los resultados de rigurosos estudios clínicos y preclínicos realizados hasta ahora, la dieta cetogénica parece ser una opción prometedora y poderosa para la terapia adyuvante para una variedad de cánceres.
En última instancia, el efecto Warburg es un área fascinante de investigación del cáncer que se ha estudiado ampliamente desde la década de 1920 con un aumento en el número de publicaciones desde la década de 2000 hasta la actualidad. Su mecanismo y papel en la génesis y proliferación del cáncer se está entendiendo gradualmente. Su comprensión es muy prometedora para encontrar una cura para muchos tipos de cáncer.
La dieta cetogénica
El físico Manfred von Ardenne, que trabajó con el Dr. Warburg, descubrió que las células cancerosas, debido a su fermentación, son más ácidas por dentro y por fuera que las células normales. Esto ha llevado a ideas de incorporar la alcalinización metabólica de la matriz extracelular para tratar el terreno del cáncer. Además, la acidez de la célula cancerosa y el metabolismo alterado la hacen más sensible a las altas temperaturas. Sobre esta base, se ha incorporado clínicamente la hipertermia de todo el cuerpo y la hipertermia local para tratar tumores.
Aquí BRMI habla sobre la hipertermia de todo el cuerpo con el hijo de Manfred von Ardenne (quien trabajó con Otto Warburg para desarrollar una terapia de múltiples pasos para tratar el cáncer).
Igualmente fascinante es la investigación de por vida de Peter Pedersen, quien describe a través de una serie de descubrimientos secuenciales que tocan cinco décadas cómo, a pesar de algún deterioro en la capacidad respiratoria de los tumores malignos, esa hexocinasa 2 (HK-2), su receptor mitocondrial (VDAC) y el El gen que codifica HK-2 (gen HK-2) desempeña los papeles más fundamentales y directos en el efecto Warburg.
También descubrieron que, como un "caballo de Troya", el simple análogo de ácido láctico 3-bromopiruvato ingresa selectivamente en las células de tumores animales cancerosos que exhiben el efecto Warburg y disipa rápidamente sus fábricas de producción de energía (ATP) (es decir, glucólisis y mitocondrias), lo que resulta en destrucción tumoral sin dañar a los animales.
Desafortunadamente, todavía no conocemos todos los "por qué" o el "propósito" del efecto Warburg, su papel en el crecimiento del cáncer y la carcinogénesis. Gran parte de esto se debe a que la atención se ha sesgado hacia la investigación basada en genes, la quimioterapia y los "productos biológicos" farmacéuticos.
Si bien el efecto Warburg es un sello distintivo del cáncer, el estudio del metabolismo de las células cancerosas se desvió cuando los investigadores comenzaron a emplear técnicas genómicas para comprender mejor la biología del cáncer. Desde entonces, la ciencia ha lamentado la falta histórica de interés y comprensión sobre el significado y el papel del efecto Warburg. Es lamentable que la investigación metabólica no haya progresado en paralelo a la investigación basada en genes.
Esta trágica historia ha impedido la plena comprensión de la biología del cáncer y, en consecuencia, el desarrollo de enfoques terapéuticos efectivos basados en la comprensión de los roles del lactato en la promoción de la carcinogénesis y la tumorigénesis.
Aunque ha habido avances importantes en la identificación de oncogenes, mutaciones supresoras de tumores y epigenética, así como algunas aplicaciones terapéuticas, la cura para el cáncer a través de la investigación basada en genes aún no se ha concretado. Gran parte de la investigación hasta la fecha apunta a la conclusión de que el cáncer puede considerarse mejor como una enfermedad metabólica en lugar de genética.
Obras notables del Dr. Warburg
Stoffwechsel der Tumoren (1926)
Katalytische Wirkungen der lebendigen Substanz (1928)
El metabolismo de los tumores (1931)
Schwermetalle como Wirkungsgruppen von Fermenten (1946)
Wasserstoffübertragende Fermente (1948)
Mecanismo de la fotosíntesis (1951)
Entstehung der Krebszellen (1955)
Weiterentwicklung der zellphysiologischen Methoden (1962)
La causa principal y la prevención del cáncer (1966)






